Хвороба Ранд - Ослера: клінічний випадок лікування синдрому
- Як не сплутати астму з іншою патологією
- Класифікація, небезпека і лікування легеневих АВМ
- За матеріалами: https://jmedicalcasereports.biomedcentral.com/articles/10.1186/1752-1947-7-32
Дитину п'ять років безуспішно лікували від важкої астми, поки не з'ясували, що насправді причина в інший рідкісної патології
11-річний хлопчик з Хорватії страждав на бронхіальну астму з шести років. За півроку до госпіталізації перебіг хвороби значно погіршився - напади астми стали погано купироваться раніше призначеними препаратами. Потім пацієнт став скаржитися на поганий апетит і часті головні болі, почали наростати задишка і ціаноз. У зв'язку з цим хлопчика поклали в терапевтичне відділення лікарні.
Маленький пацієнт скаржився на задишку при навантаженні і кілька загострень астми, одне з яких завершилося госпіталізацією в попередньому місяці. При загостреннях дитині призначали системні кортикостероїди з поступовим зниженням дозування, втім, без зменшення хронічної гіпоксії та інших симптомів. На момент надходження пацієнт отримував:
- інгаляції адреномиметика і глюкокортикостероїду (флутиказон і салметерол 250 мкг / 50 мкг два рази на день);
- бронхолитик монтелукаст - 5 мг один раз на день;
- інгаляції адреномиметика сальбутамолу в міру необхідності (на момент надходження - чотири рази в день).
З дитинства хлопчик страждав на атопічний дерматит, в грудному віці була алергія на коров'яче молоко, з трьох років турбували носові кровотечі. У шість років дитині діагностували бронхіальну астму через повторюваних епізодів хрипів і позитивного бронхопровокаціонний тесту з фізичним навантаженням. Шкірна аллергопроба показала чутливість до домашнього пилового кліща і трав'яний пилку. Після того як пацієнтові поставили діагноз «астма», його регулярно спостерігав дитячий пульмонолог. Протягом останніх двох років захворювання протікає безсимптомно - без профілактики і призначення сильнодіючих препаратів.
Коли хлопчика привезли в лікарню, його загальний стан характеризувався як «середнього ступеня тяжкості»: задишка, шкіра і видимі слизові оболонки - бліді, до синюшности, гіпоксія в стані спокою (рівень кисню в крові (SaO2) 92% при нормі ≥ 95%) . Крім того, над лівим легким вислуховуються переривчасті шуми, праворуч везикулярнедихання було ослаблено. При огляді лікарі виявили дві телеангіектазії на лівій щоці і дискретні телеангіектазії на спині. При ультразвуковому дослідженні серця патології не виявлено, легеневої гіпертензії немає.
Телеангіектазії являють собою розширення дрібних судин шкіри невоспалительной природи, які проявляються судинними зірочками або сіточками.
Спірометрія (спеціальне дослідження функції дихальної системи) показала життєву ємність легенів (ЖЕЛ) 2,65 л (79% від нормального показника), обсяг форсованого видиху в 1 секунду (ОФВ1) 2,61 л (97% норми), співвідношення ОФВ1 / ЖЕЛ = 95% (норма). Після інгаляції бронхолитика ОФВ1 і ЖЄЛ збільшилися на 5%. Однак при бронхіальній астмі приріст в такому випадку становить понад 12%.
Нехарактерні для астми показники спірометрії змусили лікарів посилити діагностичний пошук. Хлопчику призначили бронхоскопію. Вона показала здавлення лівого бронха в язичкових сегменті легкого, а на рентгенограмі в області цього бронха була видна однорідна маса м'яких тканин розміром 20 × 30 мм (рис. 1). Не можна було виключити пухлинний ріст. На щастя, при комп'ютерній томографії (КТ) виявлено не пухлина, 35-міліметрова артериовенозная мальформация (АВМ) в області здавленого бронха і невелика АВМ в верхівці правої легені (рис. 2). АВМ зліва мала одну живильну артерію і велику аневризму. Права АВМ отримувала харчування з двох артерій (рис. 3, 4).
Артеріовенозна мальформация (АВМ) - патологічна зв'язок між венами і артеріями, зазвичай вроджена. Мальформації можуть з'явитися в будь-якому органі, однак найбільш небезпечні в цереброспинальной зоні.
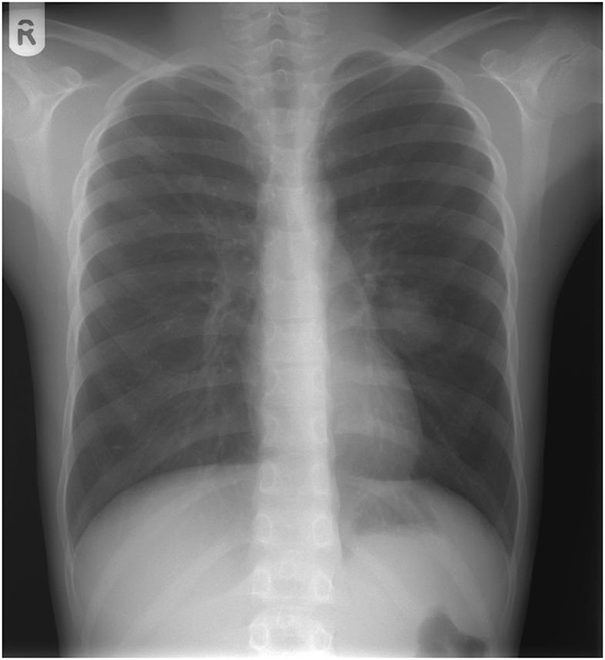
Малюнок 1. Рентген грудної клітини показав однорідну масу м'яких тканин 20 × 30 мм в язичкових сегменті лівої легені, поруч з тінню серця 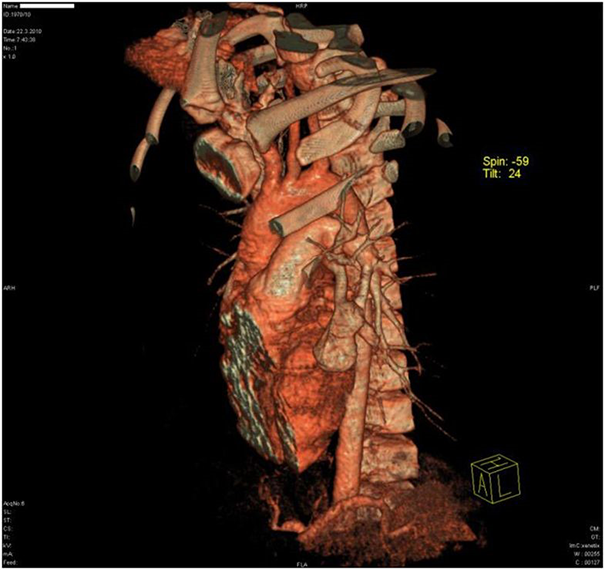 Малюнок 2. Тривимірна комп'ютерна томографическая ангіографія показала 35-мм судинну мальформацию в передній частині лівої верхньої частки з однієї живильної артерією (відгалуження легеневої артерії) і однієї відводить веною
Малюнок 2. Тривимірна комп'ютерна томографическая ангіографія показала 35-мм судинну мальформацию в передній частині лівої верхньої частки з однієї живильної артерією (відгалуження легеневої артерії) і однієї відводить веною  Малюнок 3.
Малюнок 3.
A. Артеріовенозна мальформация і аневризма сегментарной гілки легеневої артерії.
B. Стан після емболізації сегментарної лівої гілки легеневої артерії з оклюзією артериовенозной аномалії.  Малюнок 4.
Малюнок 4.
A. Артеріовенозна мальформация верхівки правої легені з двома живлять артеріями.
B. Стан після емболії однієї з артерій АВМ. C. Стан після емболії другий артерії АВМ.
Під час госпіталізації хлопчикові провели генетичний аналіз, в результаті виявилася мутація в гені трансмембранного білка ендогліна, що типово для синдрому Ранд - Ослера.
Хвороба Ранд - Ослера (Ранд - Ослера - Вебера), синдром Ослера, сімейна геморагічна телеангіектазії, - спадкове захворювання, в основі якого лежить неповноцінність судинного ендотелію, в результаті чого на різних ділянках шкіри і слизових оболонках губ, рота, у внутрішніх органах утворюються множинні ангіоми і телеангіектазії (види аномалій судин), які можуть кровоточити. Названа хвороба по іменах лікарів, які описали її в кінці XIX - початку XX століття. Передається захворювання рандом Ослера по аутосомно-домінантним типом; зустрічається у одного з 5000 чоловік.
Для лікування цього випадку хвороби рандом Ослера лікарі прийняли рішення емболізірованного (вибірково закупорити, - прим. Ред.) Мальформації в легких за допомогою спіралей з нержавіючої сталі (рис. 5). Спіралі вводили за допомогою катетера через стегнову артерію. Діаметр спіралей дорівнював або на 10% перевищував діаметр артерій, що живлять мальформації (рис. 3, 4). Після операції потік крові через АВМ припинився (рис. 6). Пульсоксиметрія показала збільшення кисневої сатурації периферичної крові з 92% до 97% безпосередньо на повітрі.
Зникла хвороблива блідість, хлопчик став краще переносити навантаження. Симптоми задухи і дихальної недостатності не виявлялися протягом всього періоду спостереження (шість місяців після процедури). Крім того, лікарі за допомогою МРТ головного мозку і шийного відділу хребта переконалися у відсутності загрожують життю пацієнта церебро-спінальних АВМ. Поглиблений збір анамнезу виявив позитивну сімейну історію хвороби Ранд - Ослера: у двоюрідного брата батька пацієнта було діагностовано АВМ в головному мозку.
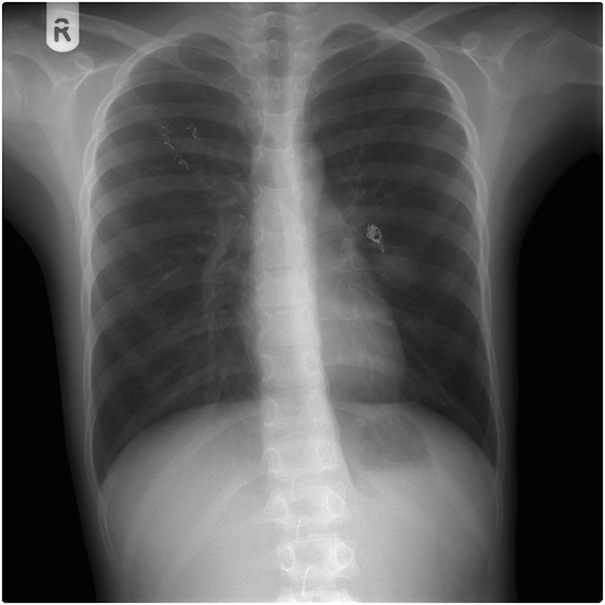
Малюнок 5. Рентгенографія грудної клітини зі сталевими спіралями після емболізації легеневих артеріовенозних мальформацій в правому і лівому легкому 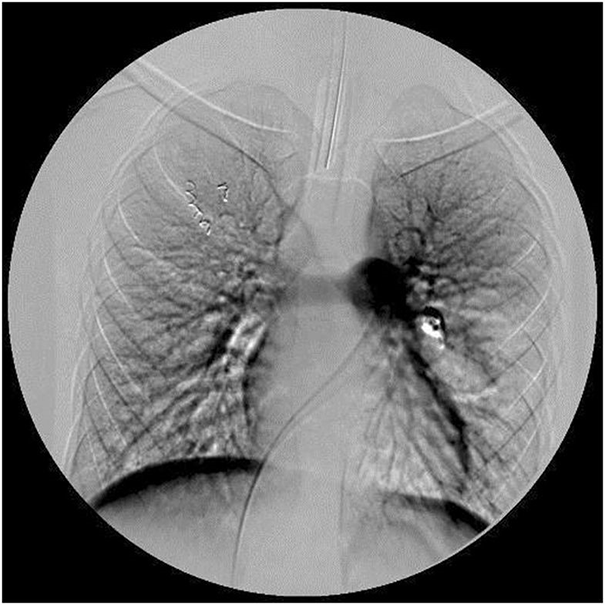 Малюнок 6. Ангіограма після емболізації легеневої артерії обох артеріовенозних мальформацій
Малюнок 6. Ангіограма після емболізації легеневої артерії обох артеріовенозних мальформацій
Як не сплутати астму з іншою патологією
Цей випадок цікавий тим, що пацієнтові спочатку неправильно діагностували бронхіальну астму і п'ять років лікували від захворювання, якого не було. Діагноз не викликав сумнівів, оскільки у хлопчика мали місце алергічна схильність, часта задишка, низька переносимість фізичних навантажень і кілька типових астматичних нападів. При КТ-ангіографії виявлено дві АВМ - по одній в правому і лівому легкому. Клінічний діагноз - хвороба Ранд - Ослера - лікарі поставили на підставі трьох критеріїв Кюрасао (носова кровотеча, слизові телеангіектазії і легеневі АВМ), а потім підтвердили генетично.
Астма - поширене захворювання, проте багато хвороб мають схожі симптоми. Це слід враховувати особливо в тих випадках, коли симптоми астми погано піддаються терапії [4]. Згідно з рішенням конгресу Американського торакального суспільства, для визначення рефрактерній або важкої астми використовуються великі і малі критерії. Великі критерії:
- а) безперервне або майже безперервне (> 50% року) лікування пероральними кортикостероїдами;
- b) необхідність лікування високодозової інгаляційними кортикостероїдами.
Малі критерії:
- а) одне або кілька загострень астми в рік;
- b) щоденне використання β2-агоніста короткої дії через симптоми астми;
- c) обструкція дихальних шляхів (ОФВ1
- d) пацієнт потребує трьох або більше пероральних курсах кортикостероїдів в рік;
- e) важкі напади задухи, з імовірним летальним результатом;
- f) погіршення стану в зв'язку зі зменшенням дози стероїдів;
- g) потрібно щоденний прийом додаткових коштів, наприклад, β2-агоніста тривалої дії, антагоніста лейкотрієнових рецепторів або теофіліну [5].
Для діагностики важко контрольованою астми необхідна наявність двох великих критеріїв або одного великого і двох малих [3]. Важко контрольована астма може бути розділена на дві підгрупи: по-перше, справжня важко контрольована астма, яка потребує ретельної діагностики та спостереження пульмонолога; і по-друге, помилкова важко контрольована астма. Чотири різні групи станів можуть бути причиною помилкової важко контрольованою астми. По-перше, неправильний діагноз астми, за яким могли ховатися вроджені аномалії верхніх дихальних шляхів, обструкція дихальних шляхів, гастроезофагеальний рефлюкс, кістозний фіброз, бронхоектатична хвороба, серцева патологія та ін. По-друге, астма з супутніми захворюваннями. По-третє, постійний вплив обтяжуючих факторів. По-четверте, недотримання схеми лікування, неправильний вибір інгаляторів або невірна техніка інгаляції [3].
Класифікація, небезпека і лікування легеневих АВМ
Легеневі АВМ - рідкісна патологія. На 15 000 послідовних розтинів виявлено тільки три випадки легеневих АВМ [6]. Клініка Майо (Рочестер, Міннесота, США, одна з найбільших клінік в світі, в ній працює близько 3800 лікарів і вчених) повідомила про 194 випадках легеневих АВМ протягом 45 років - 4,3 випадки на рік [7, 8, 9]. Легенева АВМ може бути придбаної або вродженої, і приблизно 70% випадків мальформаций пов'язані з хворобою Ранд - Ослера [10]. Легеневі АВМ в два рази частіше зустрічаються у жінок, ніж у чоловіків [11].
Легеневі АВМ можуть бути простими або складними. Простий тип (80% випадків) складається з однієї живильної артерії і однієї відводить вени, а складний тип (20% випадків) має дві або більше живлять артерії або відводять вени [12, 13]. Більше половини легеневих АВМ знаходяться в нижніх відділах, найрідше мальформації зустрічаються у верхніх відділах [12, 14]. У пацієнтів з хворобою Ранд - Ослера легеневі мальформації - множинні (35-65%) [8, 15, 16] і зазвичай пов'язані з важкими ускладненнями та інфекціями [17]. У 25% пацієнтів з синдромом Ранд - Ослера виявлені двосторонні легеневі АВМ [18].
У більшості пацієнтів з легеневими АВМ є симптоматика, яка часто розвивається між четвертим і шостим десятиліттями життя, коли з артеріальної системи в венозну через мальформації шунтируется більше 25% від загального об'єму циркулюючої крові [6, 19, 20]. Нагадаємо, що в малому колі кровообігу по артеріях тече венозна кров, а по венах - артеріальна. Задишка при навантаженні є найбільш поширеною скаргою у пацієнтів з легеневими АВМ, вона спостерігається приблизно у половини пацієнтів [15, 23, 24]. Інші симптоми: кровохаркання (приблизно у 10% пацієнтів), біль у грудях (6%), пальці в формі барабанних паличок (20%), ціаноз (18%) і торакальні шуми (3%) [15]. Симптоми хвороби Ранд - Ослера зазвичай стають помітними до 20 років (наприклад, носова кровотеча, телеангіоектазії на шкірі) [21, 22]. У нашого пацієнта була задишка при навантаженні з хронічною гіпоксією, і він був стійкий до традиційної терапії астми. Торакальний шум був виявлений при фізикальному огляді.
Класичний рентгенографічний вид легеневої АВМ - кругла або овальна маса однорідної щільності, різко виражена, частіше в нижніх частках, діаметром від одного до п'яти сантиметрів. Чутливість рентгенограми грудної клітини становить 70% при діагностиці АВМ [10]. У описаного пацієнта рентгенограма грудної клітини показала однорідну масу м'яких тканин, яка могла виявитися пухлиною. КТ-ангіографія вважається «золотим стандартом» для діагностики легеневих АВМ з чутливістю понад 97% [27].
Наявність легеневих мальформаций загрожує небезпечними для життя ускладненнями: інсульт, абсцес головного мозку, гемоторакс і кровохаркання, особливо у жінок [28, 29]. Розрив легеневої мальформації може статися в будь-якому віці, незалежно від розміру ураження [30, 31, 32]. Без відповідного лікування смертність хвороби рандом Ослера з АВМ перевищує 11% [33].
Якщо все легеневі мальформації розміром більше двох сантиметрів, або якщо живлять артерії більше двох міліметрів в діаметрі, слід лікувати хірургічно або за допомогою емболотерапіі [8, 34].
За матеріалами: https://jmedicalcasereports.biomedcentral.com/articles/10.1186/1752-1947-7-32
джерела
- Churton T: Multiple aneurysms of the pulmonary artery. Br Med J. 1897 1: 1223-1225.
- Global Initiative for Asthma (GINA), National Heart, Lung and Blood Institute (NHLBI): Global strategy for asthma management and prevention. 2006, Bethesda (MD): Global Initiative for Asthma (GINA), National Heart, Lung and Blood Institute (NHLBI), 339-Available from: http://www.ginasthma.com
- Risenga SM: Difficult-to-control asthma in children - an overview. Curr Allergy Clin Immunol. 2011, 24: 18-21.
- Weiss P, Rundell KW: Imitators of exercise-induced bronchoconstriction. Allergy Asthma Clin Immunol. 2009 5: 7-10.1186 / 1710-1492-5-7.
- American Thoracic Society: Current understanding, recommendations, and unanswered questions. In Proceedings of the ATS workshop on refractory asthma. Am J Respir Crit Care Med. 2000, 162: 2341-2351.
- Sloan RD, Cooley RN: Congenital pulmonary arteriovenous aneurysm. Am J Roentgenol Radium Ther Nucl Med. 1953 70: 183-210.
- Swanson KL, Prakash UB, Stanson AW: Pulmonary arteriovenous fistulas: Mayo Clinic experience, 1982-1997. Mayo Clin Proc. 1999 року, 74: 671-680. 10.4065 / 74.7.671.
- Dines DE, Arms RA, Bernatz PE, Gomes MR: Pulmonary arteriovenous fistulas. Mayo Clin Proc. 1974, 49: 460-465.
- Dines DE, Seward JB, Bernatz PE: Pulmonary arteriovenous fistulas. Mayo Clin Proc. 1983, 58: 176-181.
- Gossage JR, Kani G: Pulmonary arteriovenous malformation: a state of the art review. Am J Respir Crit Care Med. 1998 158: 643-660.
- Van Gent MW, Post MC, Snijder RJ, Westermann CJ, Plokker HW, Mager JJ: Real prevalence of pulmonary right-to-left shunt according to genotype in patients with hereditary hemorrhagic telangiectasia: a transthoracic contrast echocardiography study. Chest. 2010 138: 833-839. 10.1378 / chest. 09-1849.
- Burke CM, Safai C, Nelson DP, Raffin TA: Pulmonary arteriovenous malformations: a critical update. Am Rev Respir Dis. 1986, 25: 331-334.
- Remy J, Remy-Jardin M, Wattinness L, Deffontaines C: Pulmonary AVMs - evaluation with CT of the chest before and after treatment. Radiology. 1992 року, 182: 809-816.
- Frazer RG, Pare JAP, Pare RD, Frazer RS, Genereux GP: Diagnosis of Diseases of the Chest. 1989, Philadelphia: B. Saunders Company, 3
- Cottin V, Chinet T, Lavole A, Corre R, Marchand E, Reynaud-Gaubert M, Plauchu H, Cordier JF: Groupe d'Etudes et de Recherche sur les Maladies 'Orphelines' Pulmonaires (GERM'O'P). Pulmonary arteriovenous malformations in hereditary hemorrhagic telangiectasia: a series of 126 patients. Medicine (Baltimore). 2007, 86: 1-17. 10.1097 / MD. 0b013e31802f8da1.
- White RI, Lynch-Nyhan A, Terry P, Buescher PC, Farmlett EJ, Charnas L, Shuman K, Kim W, Kinnison M, Mitchell SE: Pulmonary arteriovenous malformations: techniques and long-term outcome of embolotherapy. Radiology. 1988, 169: 663-669.
- Hodgson CH, Burchel HB, Good CA, Clagett OT: Hereditary hemorrhagic telangiectasia and pulmonary arteriovenous fistula. Survey of a large family. N EngI J Med. 1959 261: 625-636. 10.1056 / NEJM195909242611301.
- Bosher LH, Blake DA, Byrd BR: An analysis of the pathologic anatomy of pulmonary arteriovenous aneurysms with particular reference to the applicability of local excision. Surgery. 1959 45: 91-104.
- Fuchizaki U, Miyamori H, Kitagawa S, Kaneko S, Kobayashi K: Hereditary haemorrhagic telangiectasia (Rendu - Osler - Weber disease). Lancet. 2003 362: 1490-1494. 10.1016 / S0140-6736 (03) 14696-X.
- Chauhan MS, Ahuja JM, Tewari SC, Jayaswal R, Dandona PK: Osler - Rendu - Weber disease presenting as recurrent hemoptysis. Indian J Chest Dis Allied Sci. 1989, 31: 227-232.
- Vase P, Holm M, Arendrup H: Pulmonary arteriovenous fistulas in hereditary hemorrhagic telangiectasia. Acta Med Scand. 1985, 218: 105-109.
- Plauchu H, de Chadarévian JP, Bideau A, Robert JM: Age-related clinical profile of hereditary hemorrhagic telangiectasia in an epidemiologically recruited population. Am J Med Genet. 1989, 32: 291-297. 10.1002 / ajmg. 1320320302.
- Begbie ME, Wallace GM, Shovlin CL: Hereditary haemorrhagic telangiectasia (Osler - Weber - Rendu syndrome): a view from the 21st century. Postgrad Med J. 2003 79: 18-24. 10.1136 / pmj. 79.927.18.
- Shovlin CL, Letarte M: Hereditary haemorrhagic telangiectasia and pulmonary arteriovenous malformations: issues in clinical management and review of pathogenic mechanisms. Thorax. 1999 року, 54: 714-729. 10.1136 / thx. 54.8.714.
- Dutton JA, Jackson JE, Hughes JM, Whyte MK, Peters AM, Ussov W, Allison DJ: Pulmonary arteriovenous malformations: results of treatment with coil embolization in 53 patients. AJR Am J Roentgenol. 1995 року, 165: 1119-1125.
- Gupta P, Mordin C, Curtis J, Hughes JM, Shovlin CL, Jackson JE: Pulmonary arteriovenous malformations: effect of embolization on right-to-left shunt, hypoxemia, and exercise tolerance in 66 patients. AJR Am J Roentgeno. 2002 179: 347-355.
- Remy J, Remy-Jardin M, Giraud F, Wattinne L: Angioarchitecture of pulmonary arteriovenous malformations: clinical utility of three-dimensional helical CT. Radiology. 1994 191: 657-664.
- Dinkel HP, Triller J: Pulmonary arteriovenous malformations: embolotherapy with superselective coaxial catheter placement and filling of venous sac with Guglielmi detachable coils. Radiology. 2002 223: 709-714. 10.1148 / radiol. 2233010953.
- Moore BP: Pulmonary arteriovenous fistula [abstract]. Thorax. 1969 24: s381 -
- Bowers WF: Rupture of visceral hemangioma as cause of death with report of a case of pulmonary hemangioma. Nebr Med J. 1936 21: 55-57.
- Shashy SS, Jones BC, Kitchens CS: Spontaneous hemothorax in a patient with Osler - Weber - Rendu disease. South Med J. 1985, 78: 1393-1394. 10.1097 / 00007611-198511000-00039.
- Chanatry BJ: Acute hemothorax owing to pulmonary arteriovenous malformation in pregnancy. Anesth Anaig. 1992 року, 74: 613-615.
- Najarian KE, Morris CS: Arterial embolization in the chest. J Thorac Imaging. 1998 13: 93-104. 10.1097 / 00005382-199804000-00004.
- Faughnan ME, Palda VA, Garcia-Tsao G, Geisthoff UW, McDonald J, Proctor DD, Spears J, Brown DH, Buscarini E, Chesnutt MS, Cottin V, Ganguly A, Gossage JR, Guttmacher AE, Hyland RH, Kennedy SJ, Korzenik J, Mager JJ, Ozanne AP, Piccirillo JF, Picus D, Plauchu H, Porteous ME, Pyeritz RE, Ross DA, Sabba C, Swanson K, Terry P, Wallace MC, Westermann CJ, White RI, Young LH, Zarrabeitia R , HHT Foundation International - Guidelines Working Group: International guidelines for the diagnosis and management of hereditary haemorrhagic telangiectasia. J Med Genet. 2011, 48: 73-87. 10.1136 / jmg. 2009.069013.
 Наш ассоциированный член www.Bikinika.com.ua. Добро пожаловать в мир азарта и удачи! Новый сайт "Buddy.Bet" готов предоставить вам широкий выбор азартных развлечений.
Наш ассоциированный член www.Bikinika.com.ua. Добро пожаловать в мир азарта и удачи! Новый сайт "Buddy.Bet" готов предоставить вам широкий выбор азартных развлечений.